Lungengewebe
Offene und thorakoskopische Lungenbiopsien
Es gibt 3 Techniken zur Lungenbiopsie, die transbronchiale, die offene oder thorakoskopische Lungenbiopsie und die transthorakale, CT- oder Ultraschall gesteuerte Lungenbiopsie. Sinnvoll für die Diagnostik bei V.a. interstitielle Lungenerkrankung ist nur die offene und thorakoskopische Lungenbiopsie.
Indikation und Planung
Immer wenn man diagnostisch nicht weiterkommt und die Lungenerkrankung signifikant und unklar oder sogar progredient ist, ist eine histologische Untersuchung des gewonnenen Lungengewebes indiziert.
- Unklarer diffuser interstitieller, infektiologischer oder neoplastischer Prozess der Lunge.
- Wichtig ist bei progredienter Erkrankung die Biopsie frühzeitig zu machen
- Es muss immer extreme Sorge getragen werden, dass die Biopsie optimal aufgearbeitet, verwertet und interpretiert wird.
- Hierzu ist letztlich das Einbringen jeder Biopsie in das Kinderlungenregister und Biobank erforderlich
- Lungenbiopsien sollten aufgrund der komplexen Aufarbeitung und Probenlogistik in routinierten Zentren durchgeführt werden.
Relative Kontraindikationen
- Radiologischer Anhalt für diffuse, im Endstadium befindlichen Lungenerkrankung, z. B. Lunge ohne Bereiche milder Krankheitsaktivität
- Schwere kardiovaskuläre Erkrankung, schwere pulmonale Dysfunktionen oder andere allgemeine Risikofaktoren für Anästhesie oder Chirurgie
- Hohe Wahrscheinlichkeit, dass angemessen große Biopsien von mehreren Orten (normalerweise zwei Lappen) nicht gewonnen werden können.
- Mechanische Beatmung und immunsuppressive Therapie verstärken das Risiko und erhöhen die Komplikationsrate
Komplikationen
- Risiko abhängig vom Allgemein- und vor allem pulmonalem Zustand
- Daher sollten Lungenbiopsien nicht zu spät vorgenommen werden!
- Pneumothorax, Blutung, Wundinfektion
- Verlängerte Intubation, Pneumonie
- Risiko steigt mit immunsuppressiver Behandlung und vorbestehender respiratorischer Insuffizienz
- Komplikationsraten zwischen 6 und 65 %
- Mortalitätsraten zwischen 3 und 38 % je nach Ausmass der vorbestehenden Grunderkrankung
- Komplikationsrate bei VAT niedriger
Technik
A) Offen
- Ein erfahrener Operateur benötigt nur wenige Minuten Operationszeit
- Inzision von 3-4 cm über dem Areal das biopsiert werden soll
- Meist latero-dorsaler oder ventraler Zugang
- Nach Eröffnen des Pleuraraums wird ein Teil der Lunge mittels Klemme erfasst und in die Thorakotomieöffnung gezogen
- Mit Hilfe eines „Staplers“ Biopsie aus zwei verschiedenen Lappen
B) VATS
- Die videoassistierte thorakoskopische Biopsie (VATS, video assisted thoracospopic surgery) wird auch in Intubationsnarkose durchgeführt
- Einseitige Lungenventilation ist notwendig und die Biopsieentnahme kann erschwert sein, wenn die Lunge nicht zusammenfällt oder multiple Adhäsionen aufweist.
- Transthorakale Trokare, einer für Kamera und einer für Stapeler und in der Regel ein Dritter zur Entgegennahme der Biopsie, werden eingeführt.
- Zugangsort frei wählbar in Abhängigkeit von der Lungenpathologie.
- Verweildauer der Drainage (wenn überhaupt eine gelegt wird) kürzer
- Hospitationsdauer ebenfalls deutlich kürzer
- Besseres kosmetisches Ergebnis
Probenaufarbeitung
Der die Lungenbiopsie in Auftrag gebende Arzt sollte diese persönlich im OP in Empfang nehmen und verarbeiten.
- Eine Lungenbiopsie wird gewöhnlich nur einmal während des Lebens eines Patienten vorgenommen, so dass der Informationsgewinn aus dieser Biopsie unbedingt maximiert werden sollte. Aus diesem Grund ist es empfehlenswert diese Untersuchung in einem Zentrum durchführen zu lassen, welches Routine in der Entnahme und Verarbeitung von Lungenbiopsien hat.
- Immer 2 Lappen biopsieren; ist sinnvoll und notwendig!
- Vermeiden der Spitzen der Lappen einschl. Lingula, da dort oft nicht spezifische fibrotische inflammatorische Läsionen
- Lobektomierte oder pneumektomierte Lungenstücke können über die Hauptbronchien mit Fixanz entfaltet werden
- Die Aufblähung kann Artefakt, z. B. durch das Auswaschen von Alveolarmakrophagen, erzeugen
- Abklatschproben für mikrobiologische Untersuchungen sollen genommen werden oder kleine Stücke direkt verarbeitet werden (Kultur, PCR)
Größe der Lungenbiopsie
- Immer wenigsten 1 cm ins Lungenparenchym von der Pleura
- Bei kleinen Kindern mindestens 1 x 1 cm Volumen, ältere Kinder sowie Erwachsene mindestens 2 x 2 cm, maximaler Durchmesser 4 cm
- Unbedingt meiden flacher, Pleurarand naher, Kanu ähnlicher Biopsien, da histologisch kaum ergiebig.
Die 4 prinzipiellen Arten der Asservierung jeder Lungenbiopsie
1. Schock-Einfrieren in OCT und flüssigem Stickstoff (N2)
Gewebe für Cryoschnitte, Immunhistologien, RNA Analytik, biochemische Untersuchungen
- Einbringen des Gewebsstückchens in eine Cellulosekapsel die OCT (Optimal cutting medium) enthält, dann sofort Schock-gefroren in flüssigem Stickstoff. Langzeitverwahrt bei – 70° C oder -196° C (Lokena 2005). Technische Details s. u. (inkl. Link)
- „Zur Not“ sofort in flüssigen Stickstoff (PCR, Biochemie). Damit entfällt die Möglichkeit viele histologische Untersuchungen durchzuführen.
Langzeitaufbewahrung: Aus dem flüssigen Stickstoff in -80 Grad Gefrierschrank und dann auf Trockeneis ins Kinderlungenregister verschicken, zur Lagerung im Stickstofftank.
2. Formalinfixierung für konventionelle Histologie
Gewebe für konventionelle Histologie
Ca. 60-70% des Gewebeblocks werden für die konventionelle Histologie formalinfixiert. Dies erfolgt in neutral gepuffertem Formalin 4%. In der Regel wird ein Stück in die eigene Pathologie und ein oder zwei andere an die Sammelstelle der Referenzpathologen des Kinderlungenregisters geschickt; ggf auch Weiterversand über die lokale Pathologie an die Sammelstelle (siehe entsprechende Formblätter im Data capture) oder aber nur Versand an die Sammelstelle der Referenzpathologen im Kinderlungenregister. Einen entsprechenden Begleitschein finden Sie nach der Probenregistrierung im Data Capture Tool des KLR.
Langzeitaufbewahrung: Lagerung in Formalin nur für relativ kurze Zeit möglich, es muss aber schließlich unbedingt eine Einbettung in einen Paraffin (=Wachsblock) erfolgen, da das Gewebe durch freigesetzte Ameisensäure sonst restlos zerstört wird. Diese Einbettung kann auch über die Sammelstelle der Referenzpathologen des Kinderlungenregisters erfolgen.
3. Glutaraldehydfixierung für Elektronenmikroskopie
Gewebe für Elektronenmikroskopie
Auch wenn das Gewebe nicht immer mittels Elektronenmikroskopie angesehen wird, so muss ein kleiner Teil doch unbedingt für alle Fälle in Glutaraldehyd fixiert werden; da eine Lagerung darin nicht längere Zeit möglich ist, muss die Einbettung in Epoxidharz erfolgen; dies wird kostenfrei durch das Kinderlungenregister / Pathologie München angeboten. Hierzu werden 3 bzw 6 (bei 2 Biopsieorten) kleine, max. 2x2 mm Stückchen in Glutaraldehyd überbracht. Verwendetes Gewebe weniger als 5 %. Es wird hierzu am Besten ein spezieller Glutaraldehyd-puffer verwendet. Die Rezeptur findet sich unten (Fixierlösung für Biopsien), alternativ können auch Aliquots beim Kinderlungenregister angefordert werden. Der Puffer muss bis zum Gebrauch gefroren (-20 Grad) gelagert werden.
Langzeitaufbewahrung: Material für die Elektronenmikroskopie kann nicht in Glutaraldehyd für längere Zeit aufbewahrt werden, sondern muss in Epon-Blöcken überführt werden oder kann z.T. im (oben beschriebenen) EMI-Puffer verwahrt werden, während ein anderer Teil in Epon eingebettet wird (Serviceleistung des KLR).
Fixierlösung für Biopsien (Letzte Änderung: 06.05.2004)
Protokoll für die Herstellung:
- 0,4 M Hepes (FW: 238,3 in A.d. ; 238,3g – 1L – 1 Mol, 95,32g – 1L – 0,4 Mol, 9,532g – 100ml – 0,4 Mol; 4,766g – 50ml – 0,4 Mol). pH: 7,4 einstellen
- 45 ml H2O auf 70°C erhitzen und 4g Paraformaldehyd dazugeben. Dies geht aber erst unter Zusatz von NaOH in Lösung. Man gibt die Lauge tropfenweise bis zur vollständigen Lösung des Aldehyds zu (die Lösung muß klar sein). Nach dem Abkühlen der Lösung wird der pH-Wert auf 7,4 eingestellt und mit 0,4M Hepes auf 100 ml aufgefüllt.
- Glutaraldehyd dazugeben, so dass die Endkonzentration 0,1% beträgt, also 400μl.
Chemikalien: Aqua ad injectabilia (Braun, Melsungen, Deutschland); Hepes (Sigma,H3375), Paraformaldehyd (Merck), Glutaraldehyd (Sigma,G6257).
Bemerkungen: Der Puffer ist 4 Wochen bei 4°C haltbar oder 1 Jahr bei –20°C, dafür jedoch kleinere Aliquots abfüllen.
4. Nativ für Erregersuche
Material für Mikrobiologie
Erstellen steriler Abklatsch – Objektträger zur Gram-Färbung von den geschnittenen Oberflächen des Biopsats. Üblicherweise werden drei Objektträger luftgetrocknet und drei alkoholfixiert. Hierdurch können rasch Mikroorganismen identifiziert werden. Verwendetes Material 0 %.
Zusätzlich gibt man für Kultur und ggf. PCR unter sterilen Bedingungen von den seitlichen Rändern oder Restteilen der Biopsie kleine Stücke in steriles Kochsalz. Aufgewandtes Gewebe weniger als 5 %.
Transport
A) bei Umgebungstemperatur (alles Material für Mikrobiologie, konventionelle Histologie, Elektronenmikroskopie)
B) Vor Ort eingefrorenes Material muss auf Trockeneis transportiert werden (Stickstoff/schock gefrorenes Gewebe)
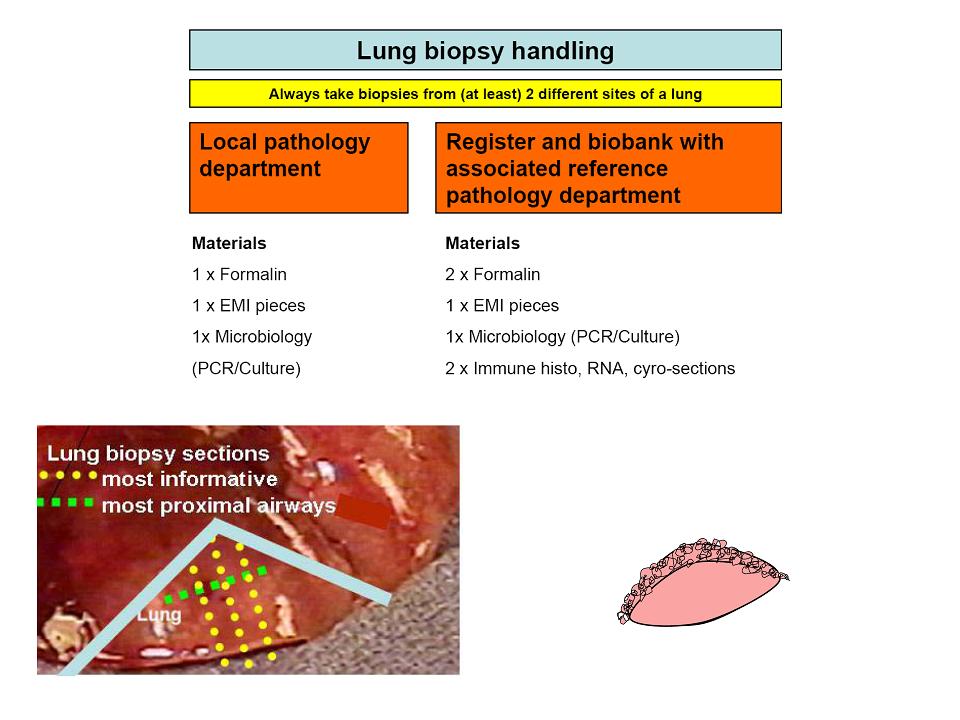
Abbildung: Prinzipielle Materialaufteilung einer Lungenbiopsie. Es geht parallel sowohl Material in die lokale Pathologie/Mikrobiologie als auch an das Kinderlungenregister, zur Weiterleitung an die Referenzpathologie und zur Asservierung für eventuell notwendige Elektronenmikroskopie und weitere Spezialuntersuchungen.
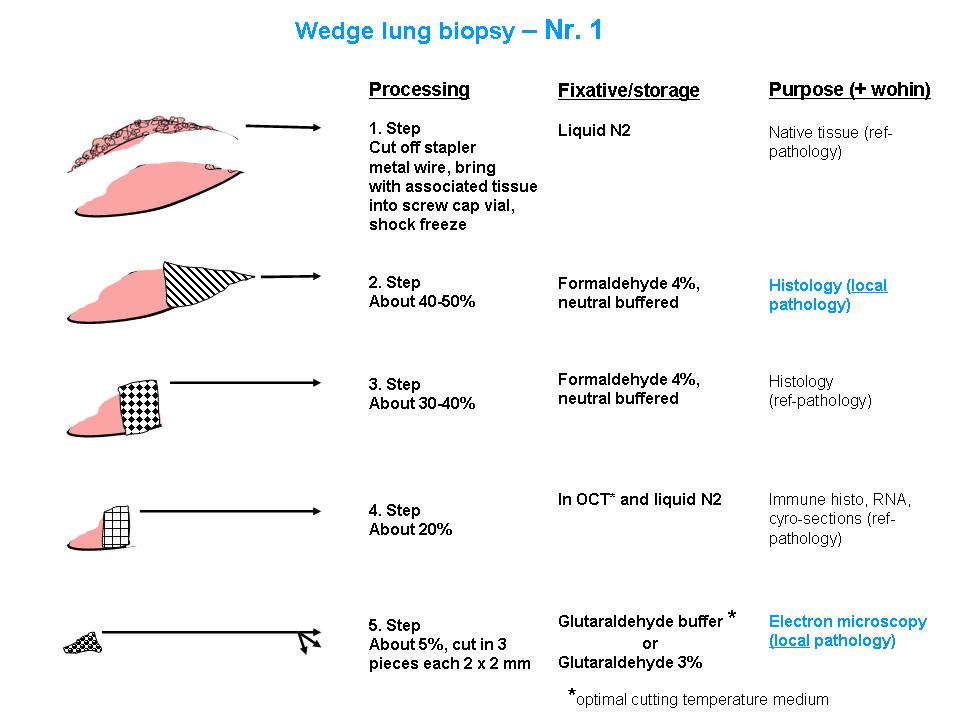
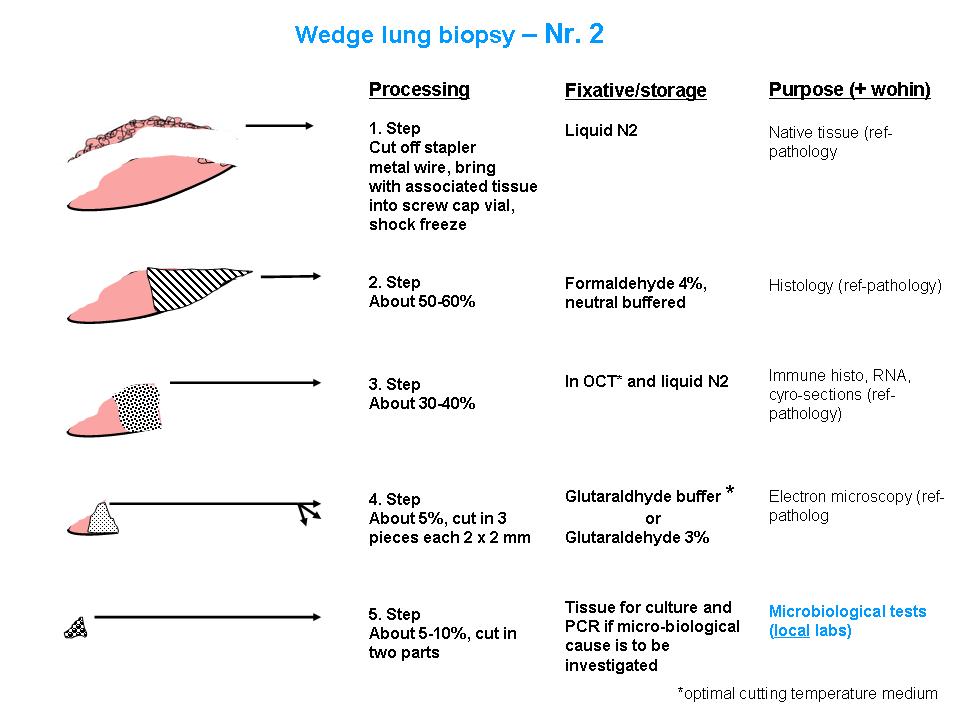
Abbildung: Detaillierte Aufteilung von Lungenbiopsien. Getrennt dargestellt für zwei Biopsien (Nr. 1 und Nr. 2). Alle Angaben sind in relativen Grössenordnungen gemacht.
Technische Details
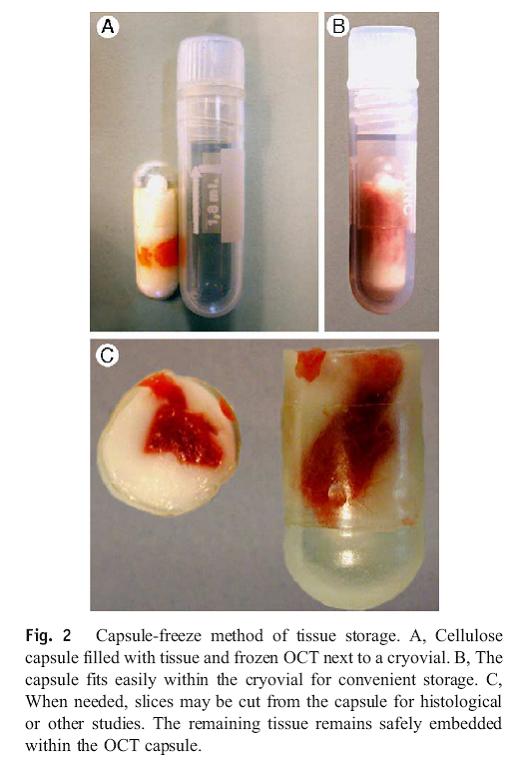
Um die Gewebsstückchen richtig einzufrieren und die weitere Verarbeitung zu gewährleisten, sollen sie in einer Cellulosekapsel, die sog. Cryomatrix, auch OCT (Optimal cutting medium) genannt enthält, verbracht und dann sofort in flüssigem Stickstoff Schock gefroren werden. Langzeitverwahrt bei – 70° C oder -196° C (Lokena 2005).
Schema:
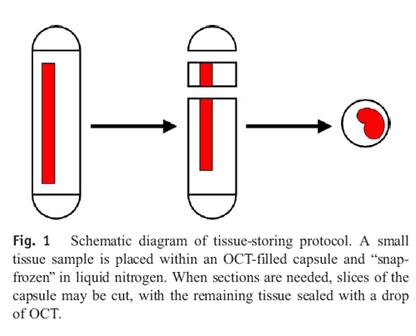
Vorgehen
Steriles Arbeiten mit Handschuhen, feiner chirurgischer Schere (oder Skalpell) und Pinzette.
Cellulosekapseln (Bestell. Nr. 09262 Größe 00 oder 000, iphas, Würselen, Germany) mit 1-2 Tropfen Cryomatrix (OCT (Tradmark)) versehen.
Gewebestück in die Cellulosekapsel einbringen.
Mit weiteren 3-5 Tropfen Cryomatrix umgeben; Luftblasen vermeiden.
Kapsel schließen und sofort in flüssigem Stickstoff verbringen.
Dann Kapsel in Cryovial überbringen und in flüssigem Stickstoff lagern bis zur Lagerung bei -80 C, bzw. Transport auf Trockeneis in die Biobank.
Immer mehrere kleine (ca 3 x 3 x 5 mm) Stückchen verarbeiten.
Probleme
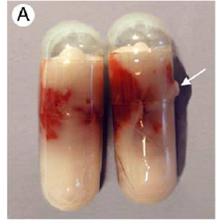
Artefacts associated with the capsule-freeze technique. One type of minor damage to gelatine capsule, showing leakage of OCT that occurred during freezing (arrow).
Ferner Link zu http://epi.grants.cancer.gov/CFR/bio_fresh_tissue_app.html)
Aufarbeitung von postmortalen Lungenbiopsien
Extrem wichtige Möglichkeit; auch nur partiell für einzelne Organe, z. B. Lunge und Leber.
Griese M, Postmortale Lungenbiopsien - ein Ausweg auch bei Menschen islamischen Glaubens! (aus El-Reshaid et al, Medical Principles and Practice, 2005)
Vorgehen
Wie oben, nur unbedingt darauf achten, dass die Stücke nicht zu groß sind, da sie sonst nicht gut fixieren. Dazu besser auch kleinere (1 x 1 cm) Stücke an mehreren Stellen entnehmen.
Nativ in flüssigem Stickstoff kann möglichst viel Material eingefroren werden.
Literatur:










